 2024年8月16日
2024年8月16日

心肌梗死(MI)是一种主要的心血管事件,心肌梗死后,炎症反应对于激活心脏修复机制至关重要。然而,这种反应的长期激活可导致不良的心脏重塑。尽管先前的研究已经强调了心肌梗死后炎症反应的时间和阶段特异性,但炎症如何促进心血管纤维化的复杂动力学尚未完全了解。2024年6月北京中医药大学王勇、李春等团队一篇题为“Activation of the Macrophage-Associated Inflammasome Exacerbates Myocardial Fibrosis Through the 15-HETE-Mediated Pathway in Acute Myocardial Infarction”的研究成果发表在Engineering期刊上,该研究表明在心肌梗死后第三天,巨噬细胞内的NLRP3炎性小体活性增加,随后扩展到成纤维细胞,抑制NLRP3表达可减少心肌纤维化。并且巨噬细胞相关的NLRP3炎性小体激活可能主要通过15-HETE信号通路显著促进成纤维细胞向肌成纤维细胞的转化。
迈维代谢为该研究提供了氧化脂质靶向代谢组检测。

研究方法:
组学方法:氧化脂质靶向代谢组检测分析,单细胞RNA测序数据分析等;
其他方法:组织和免疫荧光染色,Western blot实验,质谱成像(MSI)实验等;
研究结果:
1.LAD结扎后心功能的时间过程评估
LAD结扎后心功能的时间分析如图1所示:图1a描绘了该研究的过程流程图;图1b展示了不同心肌梗死(MI)时间间隔下的典型心脏图像和M型超声心动图。超声心动图数据显示,与体内平衡(Hom)对照组相比,实验组的心功能随时间逐渐下降,表现为左心室射血分数(LVEF)和左心室短轴缩短率(LVFS)显著降低。通过苏木 精-伊红(H&E)染色和马松三色染色法进行的组织学检查表明,Hom组的心肌细胞排列有序,而实验组的心肌细胞排列紊乱(图1c)。在心肌梗死后第三天,炎症浸润和细胞溶解增加,最终导致胶原沉积和随后的间质纤维化。在生理条件下,心肌细胞细胞质中存在心肌肌钙蛋白I(cTn-I)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)和乳酸脱氢酶(LDH)等生物标志物,这些标志物血清水平的升高可作为心力衰竭(HF)的临床指标。研究结果显示,与Hom组相比,实验组中这些心力衰竭相关生物标志物的水平显著增加(图1d)。
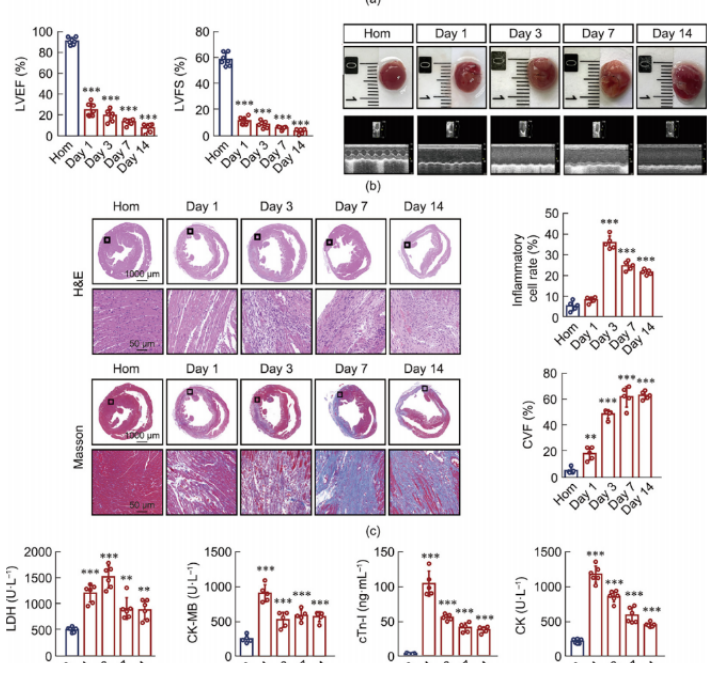
图1.LAD结扎后不同时间点心功能评价
2.在心肌梗死模型小鼠中,NLRP3炎性小体被动态激活
已有文献记录了心肌梗死(MI)模型小鼠中NLRP3的动态激活,且越来越多的证据表明炎性小体在MI中起着至关重要的作用。然而,NLRP3炎性小体在MI整个过程中的具体激活时间线尚未明确。该研究评估了心脏NLRP3炎性小体相关蛋白的表达水平以及MI后不同时间点炎症细胞因子IL-18和IL-1b的水平。图2a显示,与假手术组小鼠相比,模型组小鼠血清中IL-18和IL-1b水平显著升高。通过免疫荧光观察发现,MI后NLRP3炎性小体的激活与MI持续时间直接相关(图2b)。此外,Western blot分析显示,MI后NLRP3、ASC、切割型caspase-1、切割型IL-18和气孔蛋白D N端片段(GSDMD-NT)的蛋白表达随时间增加,第三天达到峰值,然后逐渐下降至第14天(图2c)。这些结果证实了MI后NLRP3炎性小体的时间激活模式。
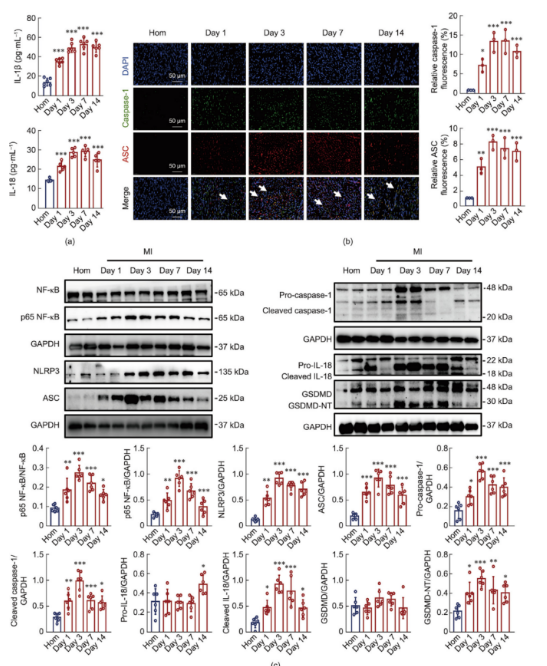
图2.心肌梗死后NLRP3炎性体激活的时间特征
3.Nlrp3基因敲除抑制心肌梗死引起的心肌损伤
为了反映心肌梗死(MI)中炎症小体激活的动态特性,研究人员成功建立了心肌梗死模型,包括表达或不表达Nlrp3基因的小鼠,如图3a所示。LAD动脉结扎导致左心室舒张内径(LVID;d)和左心室收缩内径(LVID;s)增加,而左心室射血分数(LVEF)和左心室短轴缩短率(LVFS)降低。与之前的观察结果一致,苏木 精-伊红(H&E)染色和马松三色染色证实了心肌梗死引起的心肌损伤(图3b)。至关重要的是,Nlrp3基因的敲除抑制了LAD触发的NLRP3激活(图3c)以及随后的IL-1b和IL-18的产生,从而减轻了LAD引起的心脏功能障碍和心肌损伤。通过腹腔注射NLRP3抑制剂MCC950(10 mg·kg⁻¹),进一步证实了体内炎症小体的作用(图3d–f),这表明NLRP3炎症小体的激活在LAD诱导的心肌梗死中至关重要,而其抑制则提供了心脏保护作用。
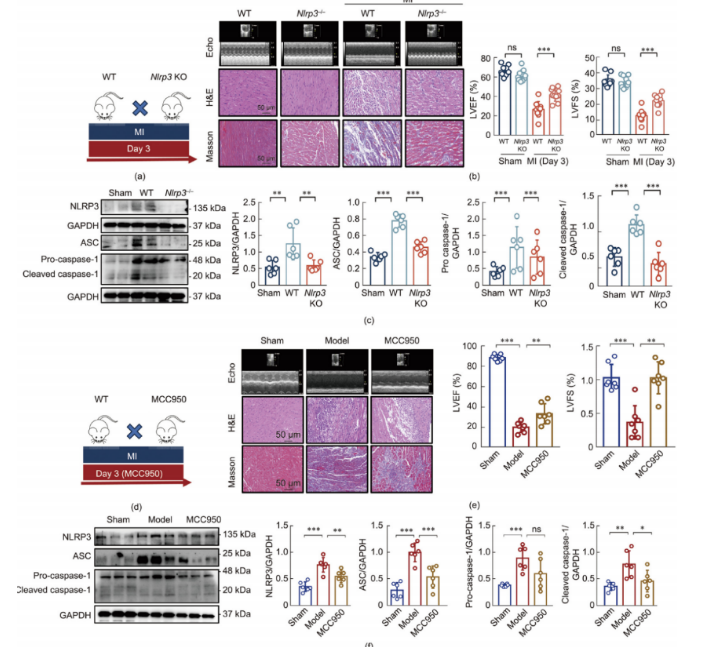
图3.抑制NLRP3激活可减轻心肌梗死后的心肌损伤
4.NLRP3炎性小体的激活主要发生在心肌梗死后第3天的巨噬细胞中
在心肌梗死(MI)模型中,发现巨噬细胞中的NLRP3炎症小体主要在心肌梗死后第三天被显著激活。这一发现不仅揭示了NLRP3炎症小体在心肌梗死过程中的时间动态性,还促使研究人员进一步探索不同细胞类型中NLRP3炎症小体激活的差异。利用数据库支持的单细胞测序数据分析,展示了心肌梗死后不同时间点及不同细胞类型中NLRP3炎症小体激活的变化情况(图4a)。利用t-SNE分析,将来自心肌梗死后第1天、第3天和第7天的心血管细胞数据进行整合,成功识别出六种细胞类型:成纤维细胞、壁细胞、内皮细胞、巨噬细胞、淋巴样细胞和增殖细胞。特别值得注意的是,心肌梗死后第三天,巨噬细胞的比例显著增加。免疫荧光染色实验(图4b),结果显示与假手术组相比,心肌梗死模型小鼠心肌中的ASC(凋亡相关斑点样蛋白,NLRP3炎症小体的重要组成部分)免疫阳性细胞数量显著增加。通过标记不同细胞类型,研究人员发现心肌梗死后第三天,巨噬细胞内的ASC荧光强度增加最为显著,强调了巨噬细胞在心肌损伤后的先天免疫反应和组织修复中的关键作用。
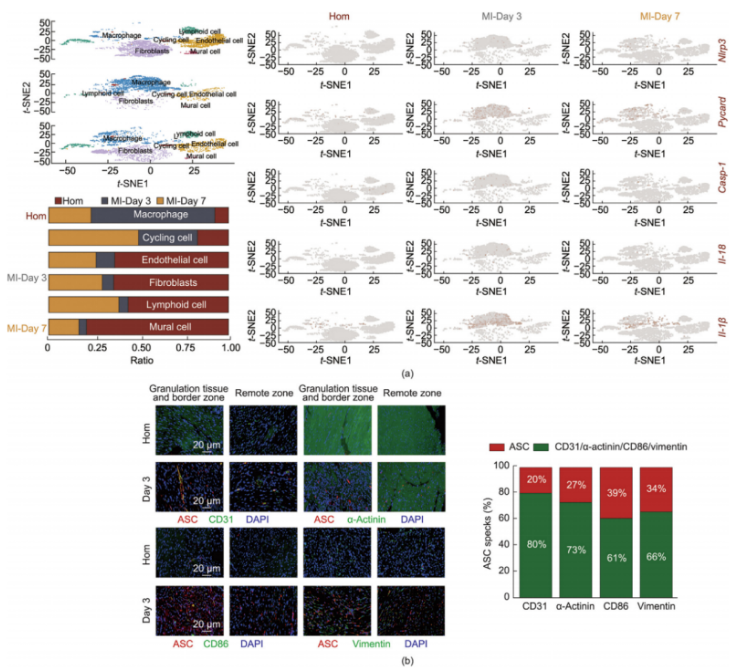
图4.心肌梗死后第三天,巨噬细胞中NLRP3被激活
5.LPS刺激巨噬细胞培养液诱导心肌纤维化
BMDMs(骨髓来源的巨噬细胞)暴露于LPS以模拟体外微生物病原体感染的分子模式(图5a)。对照组显示NLRP3蛋白表达最低,且NLRP3炎症小体复合物形成不频繁。相反,LPS暴露后,NLRP3炎症小体相关蛋白的表达显著增加,包括ASC、切割的caspase-1、IL-1b和IL-18。对LPS处理或未处理BMDMs中NLRP3表达的免疫荧光分析证实了Western blot的结果(图5b和c)。值得注意的是,LPS触发的炎症小体激活并未在BMDMs中引起细胞焦亡,这可能是由于LPS的细胞外刺激性质所致。在验证LPS诱导的巨噬细胞中NLRP3激活后,进一步研究了巨噬细胞相关炎症小体在体外心肌纤维化中的作用。通过将从大鼠心室中提取的心脏成纤维细胞(CFs)与巨噬细胞条件培养基(CM)共培养,建立了一种新型的心肌纤维化模型。将LPS(1 μg/mL)刺激BMDMs衍生的CM与CFs共培养8小时,然后将该CM用DMEM稀释至其原始浓度的四分之一(CM/4)和八分之一(CM/8)。成纤维细胞向肌成纤维细胞的转化,以胶原蛋白的产生和α-平滑肌肌动蛋白(α-SMA)的表达为标志,是心肌纤维化的主要指标。用CM/4或CM/8处理的成纤维细胞(CFs)中I型胶原蛋白和α-平滑肌肌动蛋白(α-SMA)的表达显著高于LPS处理组或对照组细胞(图5d)。此外,免疫荧光染色显著证实了CM/4诱导了心肌纤维化(图5e)。这些发现证实了通过条件培养基(CM)成功在体外诱导了心肌纤维化的细胞模型。
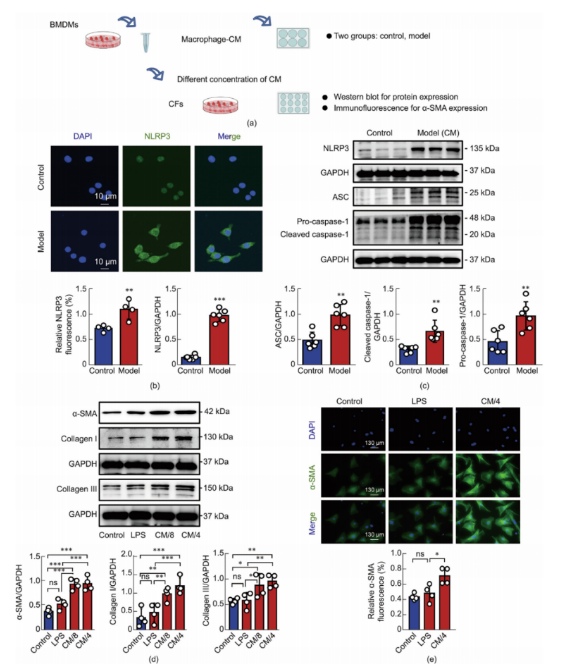
图5.LPS刺激的巨噬细胞-CM诱导成纤维细胞心肌纤维化模型
6.巨噬细胞Nlrp3沉默可有效抑制体外心肌纤维化
为了进一步阐明NLRP3在巨噬细胞相关炎症小体活性中的作用,对BMDMs进行了si-Nlrp3处理,可有效敲低Nlrp3表达的情况。Western blot结果显示,LPS刺激增加了与炎症小体激活相关的蛋白质的表达。然而,在si-Nlrp3处理后进行的LPS刺激并未触发炎症小体的激活(图6a)。NLRP3激活的免疫荧光分析结果与Western blot结果一致(图6b),表明si-Nlrp3转染显著抑制了巨噬细胞中炎症小体的激活。进一步研究si-Nlrp3治疗BMDMs后巨噬细胞相关炎性体活化对CFs刺激的心肌纤维化的影响。双重免疫荧光显示,在si-Nlrp3处理后给予CM/4显著降低了CFs中α-SMA和波形蛋白的表达(图6c)。胶原I/III的Western blot结果与免疫荧光结果一致(图6d),表明si-Nlrp3对巨噬细胞中的心肌纤维化具有显著的抑制作用。
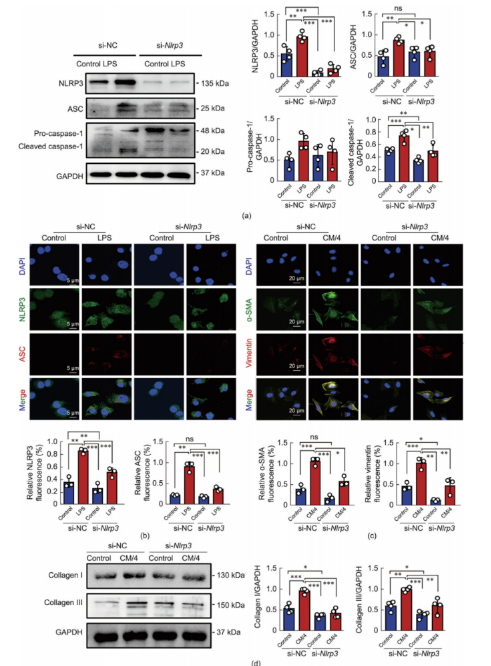
图6.si-Nlrp3治疗可保护成纤维细胞免受巨噬细胞CM诱导的心肌纤维化
7.激活15-HETE/Smad通路是巨噬细胞相关炎性小体激活诱导的肌成纤维细胞转化的主要机制
对巨噬细胞培养上清液诱导的心脏纤维化模型进行氧化脂质靶向代谢组学检测分析,结果显示对照组、模型组和Nlrp3沉默组之间存在明显的表达差异。正交偏最小二乘判别分析(OPLS-DA)表明该方法具有高度可靠性(图7a)。巨噬细胞培养上清液中15-HETE水平升高,进一步强调了其在NLRP3炎性小体诱导的心脏损伤中的潜在作用。与这些发现一致,15-HETE能够增强α-SMA和波形蛋白的表达(图7b),并上调成纤维细胞中磷酸化(p)-Smad2/3、胶原蛋白I和胶原蛋白III的表达(图7c),进一步验证了该途径在纤维化中的作用。最后,研究人员对15-HETE与TAK1蛋白进行了分子对接分析,发现15-HETE与TAK1的结合位点具有良好的空间互补性。TAK1与15-HETE之间形成了氢键(ARG-392和TYR-587)。这些数据表明,si-Tak1对成纤维细胞中胶原蛋白I/III的表达具有显著的抑制作用(图7d)。
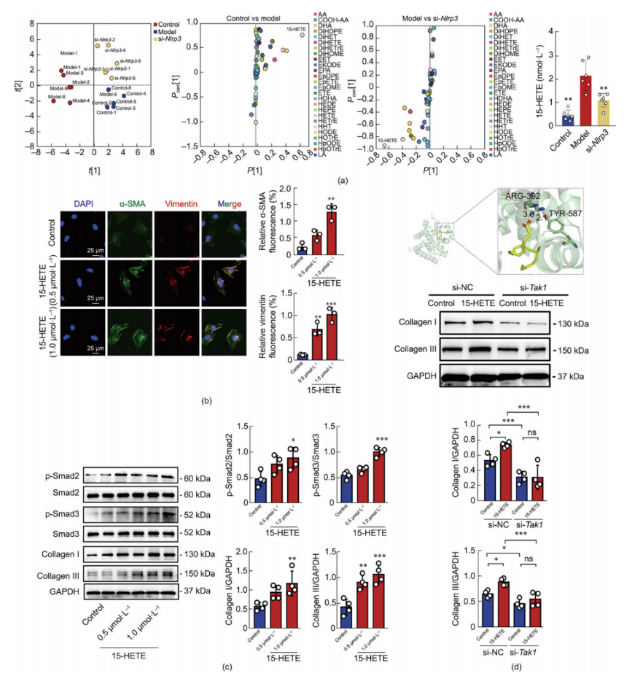
图7.15-HETE/Smad通路的激活是巨噬细胞相关炎性小体激活诱导成肌成纤维细胞转化的主要原因
8.心肌梗死和ACS患者的15-HETE水平
为了研究15-HETE在人类受试者中的分布变化,研究人员招募了5名接受心室动脉瘤手术切除的心肌梗死(MI)患者。通过苏木 精-伊红(H&E)染色确认了心脏病变的存在(图8a)。利用质谱成像(MSI)技术测定了石蜡包埋心肌组织中15-HETE的分布情况,发现梗死区及梗死周边区心肌组织中的15-HETE水平显著高于正常组织(图8b)。此外,还招募了231名急性冠脉综合征(ACS)患者(包括ST段抬高型心肌梗死和不稳定型心绞痛,其病理特征与LAD结扎模型小鼠一致),并测定了他们的血清15-HETE水平。与健康对照组相比,ACS患者的血清15-HETE水平显著升高(图8c)。综上所述,小鼠心肌梗死研究和初步的人类受试者研究表明,15-HETE在心肌纤维化和心室功能中可能发挥重要作用。
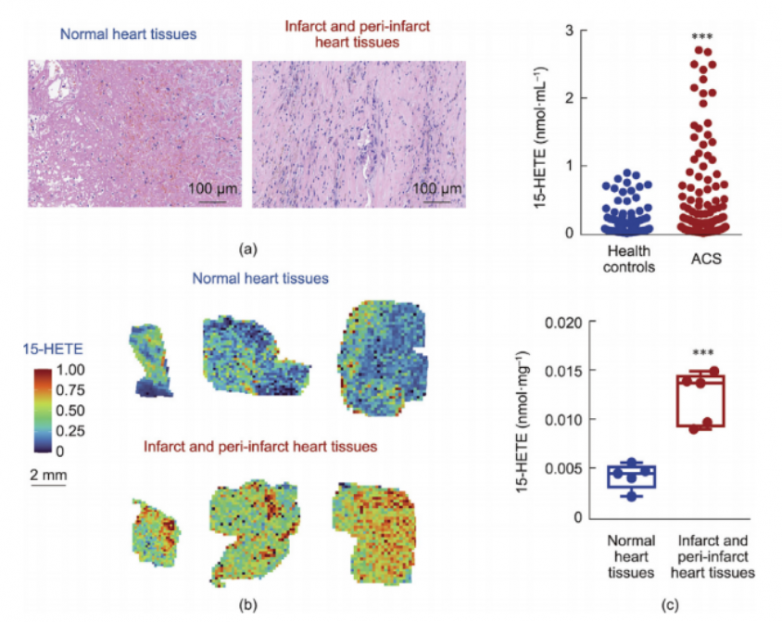
图8.心肌梗死和ACS患者的15-HETE水平
文章小结
综上所述,该研究揭示了心肌梗死后炎症小体激活的时空动态变化。此外,还发现心肌梗死后巨噬细胞中NLRP3炎症小体早期激活,这可能导致心肌成纤维细胞通过15-HETE介导的Smad通路转化为肌成纤维细胞,从而加剧心肌纤维化的易感性并导致心功能恶化。这些数据表明巨噬细胞炎症小体的激活促进了心肌梗死后心肌纤维化的发生,为心肌梗死后心力衰竭患者治疗策略的开发提供了见解。
迈维代谢提供全面的氧化脂质靶向代谢组检测方案,通过精准的靶向检测和个性化的分析服务,支持科学研究并推动临床转化,促进健康管理和疾病治疗。


